Retourner à : H4V Médecine d’urgence : Les essentiels
0
Épanchement péricardique
et péricardiocentèse
La tamponnade cardiaque est définie comme un défaut de remplissage ventriculaire lié à la présence d’un épanchement péricardique à l’origine d’une réduction du volume d’éjection systolique et donc du débit cardiaque.
Épanchement péricardique et tamponnade ne sont pas synonymes !
On parle de tamponnade lorsque la pression dans le péricarde dépasse la pression dans le cœur droit en diastole. L’épanchement péricardique fait alors pression sur le cœur et limite en premier lieu le remplissage des cavités cardiaques à basse pression (atrium droit et ventricule droit).
Deux conséquences majeures du défaut de remplissage cardiaque :
⊕ le sang s’accumule en amont du cœur droit (résistance au retour veineux), conduisant à une congestion veineuse systémique
⊕ le cœur droit dispose de moins de sang à pomper et envoyer dans la circulation pulmonaire (hypoperfusion pulmonaire) et, par conséquent, dans la circulation systémique. Ça conduit à une diminution du débit cardiaque : il s’agit d’une forme de choc cardiogénique
Notions de physiopathologie
Le péricarde est le sac entourant le cœur, composé de deux feuillets. Physiologiquement, il ne contient qu’une très faible quantité de liquide séreux ayant un rôle de lubrifiant.
L’épanchement péricardique est l’anomalie péricardique la plus fréquente chez le chien. Il concerne le plus souvent des chiens âgés, de grande race.
La plupart des épanchements péricardiques sont hémorragiques ou séro-hémorragiques.
Dans la très grande majorité des cas (presque 50/50), l’origine de l’épanchement péricardique est :
⊕ néoplasique : hémangiosarcome, tumeur de la base du coeur (comme le chémodectome), mésothéliome principalement
⊕ ou idiopathique
D’autres causes sont possibles, bien moins fréquemment :
⊕ rupture atriale gauche
⊕ coagulopathie
⊕ traumatisme pénétrant
⊕ arythmies (causes diverses : myocardite, ingestion de mégots, etc)
Le péricarde est peu compliant. Ainsi, un épanchement péricardique qui s’est rapidement accumulé peut entraîner des signes graves de tamponnade même avec un volume de liquide relativement faible.
Lors d’accumulation chronique, des mécanismes de compensation ont eu le temps de se mettre en place, limitant les conséquences cliniques de l’épanchement. L’activation du SRAA (système rénine-angiotensine-aldostérone) permet une rétention d’eau qui augmente la pré-charge et compense l’augmentation de pression intra-péricardique. Cela limite donc les signes de choc cardiogénique. Le péricarde externe se distend progressivement, conduisant à des épanchements de volumes plus importants.
Présentation clinique
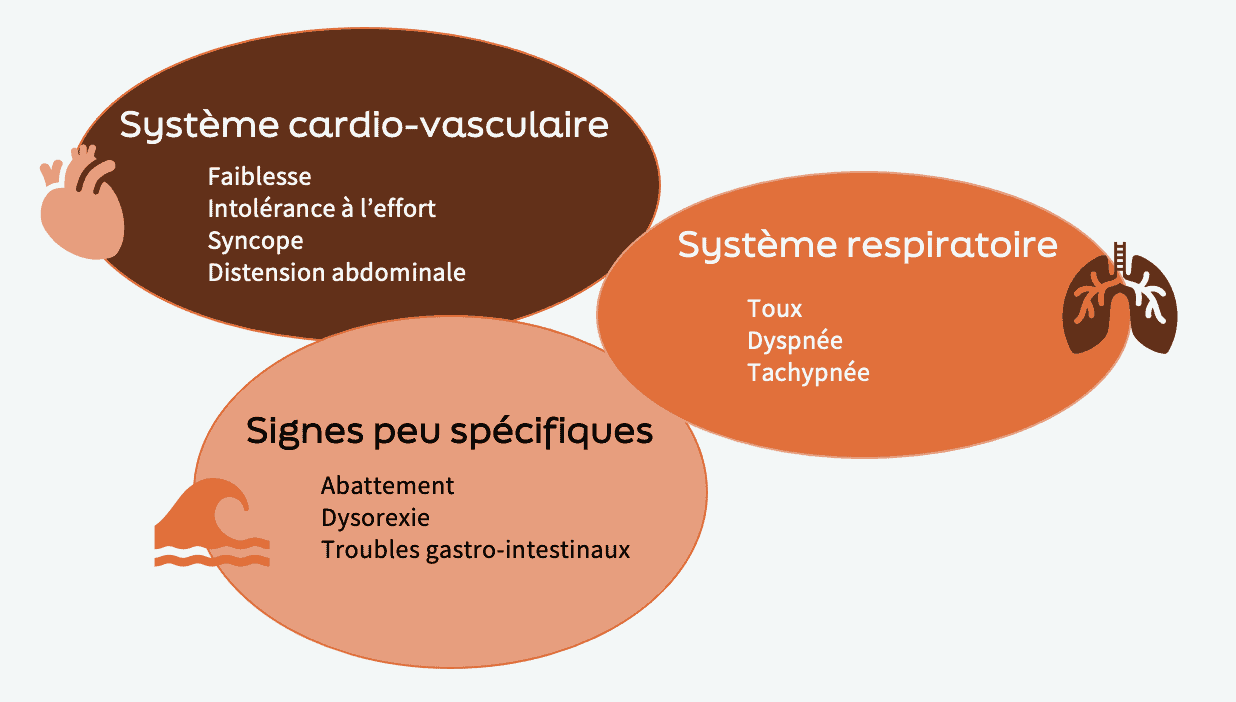
Le tableau clinique reflète généralement la baisse de débit cardiaque et la congestion veineuse
en amont du cœur droit.
Symptômes rapportés
Typiquement, un chien en tamponnade sera présenté pour des signes relatifs à une dysfonction cardio-vasculaire et/ou respiratoire, associés à des signes généraux.
Lors de tamponnade aiguë, l’animal peut être présenté en état de choc pouvant entraîner rapidement la mort. Dans ces cas-là, une distension des veines jugulaires et une hypotension peuvent être observés sans ascite ou cardiomégalie à la radiographie.
Examen clinique
Anomalies cardio-vasculaires :
bruits cardiaques peu audibles
signes de choc (tachycardie, muqueuses pâles, augmentation du TRC)
pouls paradoxal
distension des veines jugulaires
Autres anomalies cliniques :
tachypnée, dyspnée
distension abdominale +/- signe du flot positif, hépatomégalie
La palpation d'un pouls paradoxal est pathognomonique !
Le pouls paradoxal correspond à une amplification de la variation de pression artérielle en fonction de la phase respiratoire. L’inspiration diminue la pression intra-péricardique et atriale droite, ce qui facilite le remplissage du ventricule droit. Le remplissage du ventricule gauche est quant à lui diminué, ce qui est à l’origine d’une diminution du débit cardiaque. Chez l’animal normal, cette variation de pression artérielle n’est pas ressentie à la palpation du pouls fémoral. Chez l’animal souffrant de tamponnade cardiaque, la diminution du débit cardiaque à l’inspiration est amplifiée : on peut donc palper une variation d’intensité du pouls fémoral en fonction de la phase respiratoire (pouls moins marqué à l’inspiration).
Les examens complémentaires adaptés
L’examen de choix permettant de confirmer la présence d’un épanchement péricardique est l’échographie (POCUS). D’autres outils, certes moins performants mais facilement accessibles, peuvent suggérer la présence d’un épanchement péricardique et d’une tamponnade. Il s’agit notamment de la radiographie et de l’ECG. L’utilisation de l’échographie reste primordiale pour la réalisation d’une péricardiocentèse en tout sécurité !
L’échocardiographie est l’examen de choix pour l’exploration des causes d’épanchement péricardique. Le scanner ne semble pas montrer de supériorité comparé à l’échocardiographie, mais présente un intérêt pour un éventuel bilan d’extension.
Radiographie
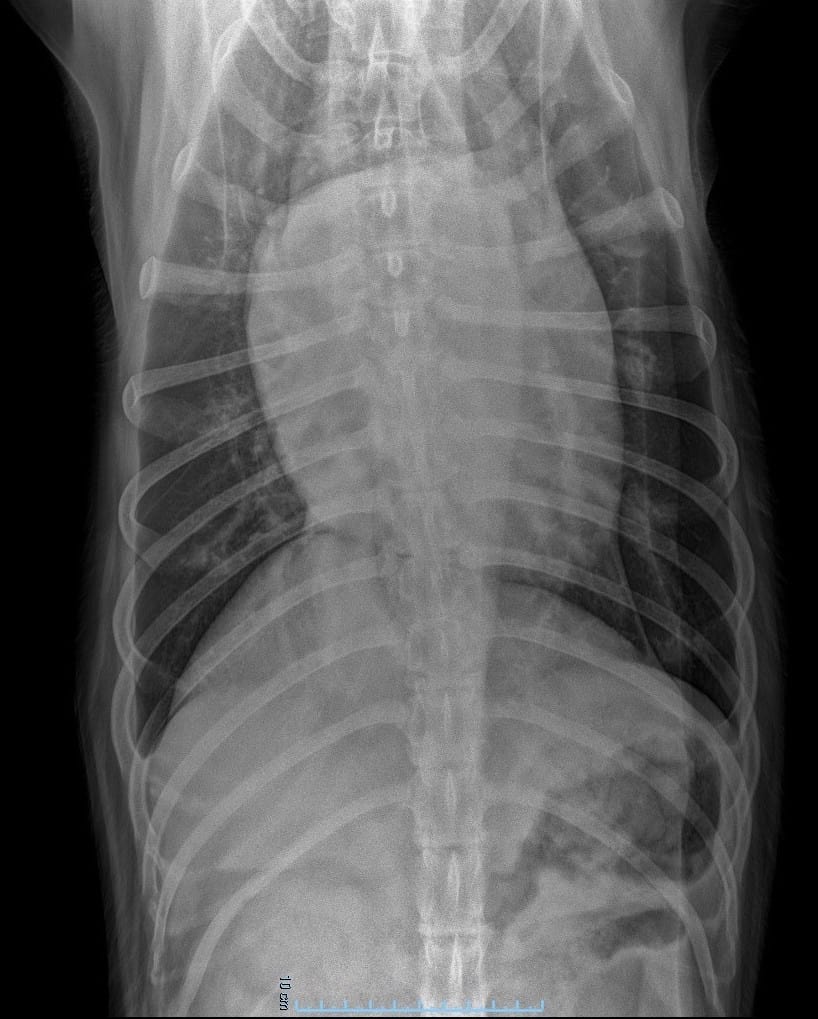
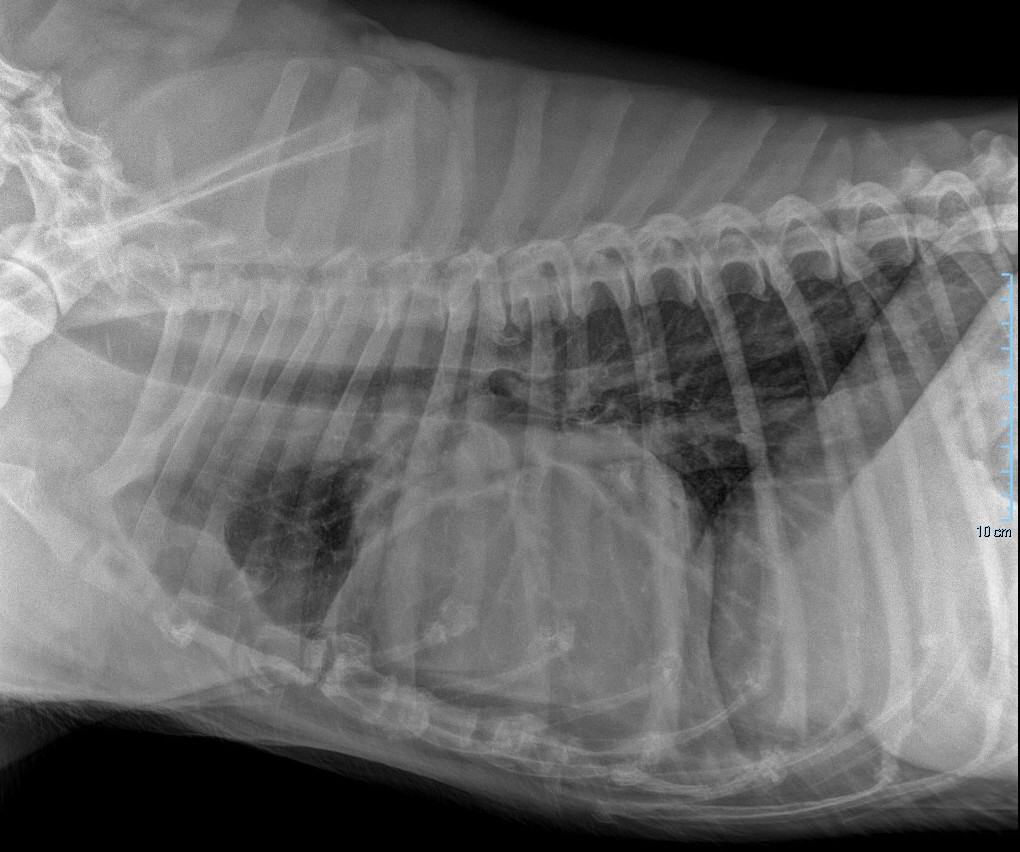
Classiquement, les anomalies radiographiques observées chez un animal présentant un épanchement péricardique sont :
⊕ élargissement et aspect globoïde de la silhouette cardiaque
⊕ hépatomégalie
⊕ dilatation de la veine cave caudale
⊕ ascite
⊕ épanchement pleural
L'épanchement péricardique n'est pas la seule cause de silhouette cardiaque globoïde
Certaines affections cardiaques non péricardiques telles que des myocardiopathies dilatées peuvent donner des images radiographiques équivoques et être confondues avec des épanchements péricardiques !
Très rarement, une dilatation des veines pulmonaires associée à des signes d’œdème pulmonaire peuvent être observés.
Une attention particulière doit être prêtée à la présence de métastases pulmonaires ou vertébrales.
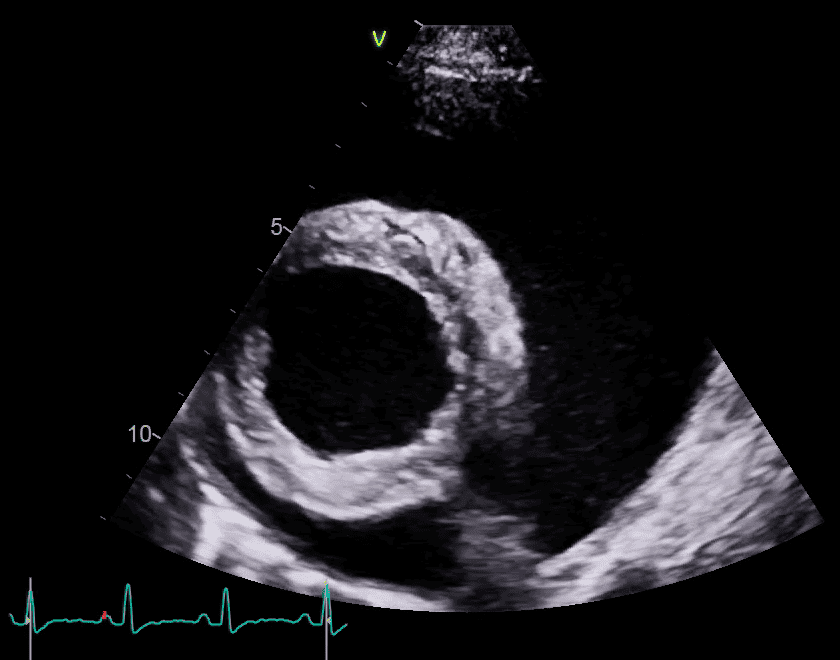
Échographie / POCUS
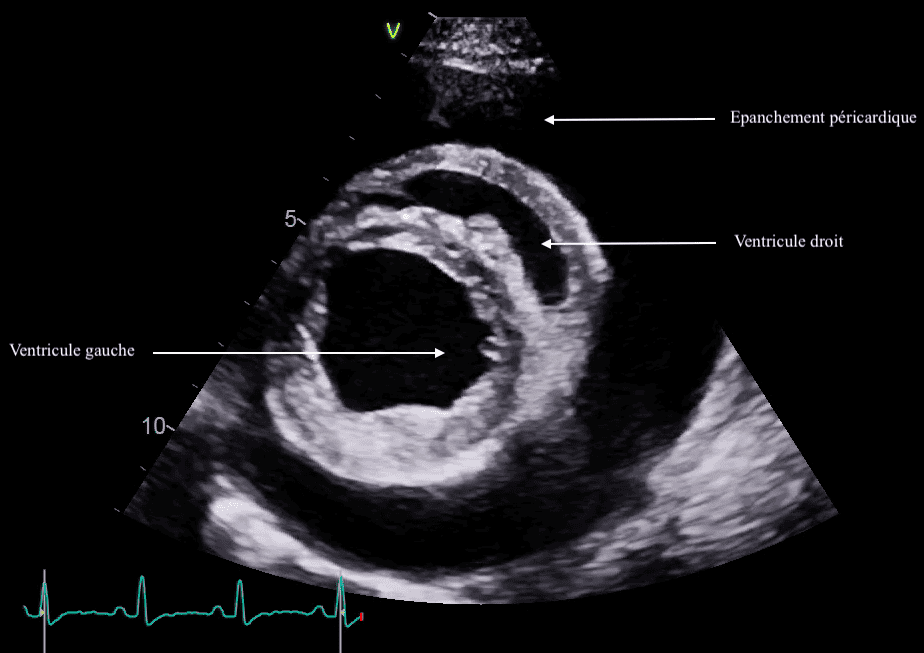
L’épanchement péricardique se caractérise par un espace anéchogène circonscrit autour du cœur, entre le péricarde hyperéchogène et l’épicarde.
La coupe échographique est importante !
Il est primordial de pouvoir observer l’intégralité du cœur afin de ne pas confondre un épanchement pleural avec un épanchement péricardique !
Le diagnostic de tamponnade est obtenu par l’observation de la paroi atriale droite collabée en systole et/ou de la paroi ventriculaire droite collabée en diastole (comme sur l’image de droite ci-dessous).
Une masse intra-péricardique, pariétale cardiaque ou au niveau de la base du cœur peut être observée (facilité par la présence de l’épanchement !).
L’échographie peut mettre en évidence des anomalies au sein de la cavité abdominale : ascite, hépatomégalie, œdème de la paroi de la vésicule biliaire ou encore dilatation de la veine cave caudale.
Électrocardiogramme
Des anomalies à l’ECG doivent être recherchées, puisque certaines peuvent nécessiter la mise en place d’un traitement.
Il est possible d’observer :
⊕ une alternance électrique
⊕ une diminution de l’amplitude des QRS
⊕ une tachycardie sinusale
⊕ ou parfois des arythmies ventriculaires ou atriales
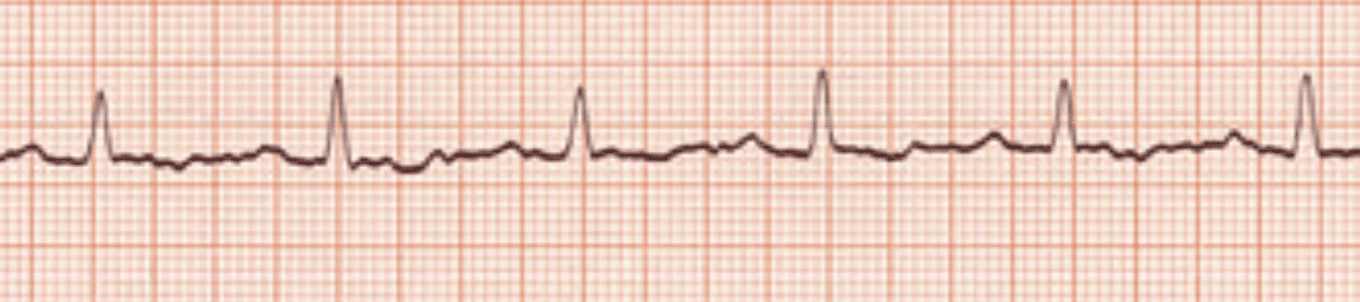
L'alternance électrique est caractéristique d'un épanchement péricardique important !
Elle correspond à une variation de taille ou de configuration du QRS, et parfois de l’onde T, d’un battement cardiaque à l’autre et s’explique par les mouvements du cœur qui se balance au sein de l’espace péricardique rempli de liquide.
Analyse de l'épanchement
Il est toujours intéressant de procéder à l’examen de l’épanchement péricardique, même si ce-dernier n’est que rarement diagnostique. Une mesure du microhématocrite sur épanchement et une analyse cytologique (avant et après centrifugation) sont des tests rapides et réalisables au chevet du patient.
La très grande majorité des épanchements sont de nature hémorragique. Par ailleurs, l’analyse cytologique permet de mettre en évidence certaines tumeurs exfoliantes (lymphome notamment, et parfois mésothéliome) ainsi que des agents pathogènes. Il s’agit donc plutôt d’un examen permettant d’exclure une origine septique et certains types de tumeurs.
L’épanchement abdominal secondaire à la tamponnade est le plus souvent non caractéristique.
Diagnostic définitif
⊕ Néoplasique vs Idiopathique
Le diagnostic d’épanchement péricardique idiopathique est un diagnostic par exclusion. Ce diagnostic peut être délicat du fait que certaines tumeurs ne sont pas visualisables facilement à l’échocardiographie. En effet, les mésothéliomes ne forment généralement pas de masse organisée et certaines tumeurs organisées (certains chémodectomes) présentent des tailles réduites et une localisation très dorsale qui les rendent difficiles ou impossibles à identifier notamment lors de la première échographie. Un suivi échocardiographique est ainsi conseillé, à distance de l’épisode de tamponnade en l’absence de cause d’épanchement identifié. En effet, une masse péricardique peut devenir visible dans les semaines suivant l’examen initial.
⊕ Rupture atriale gauche
Bien qu’assez rare, la rupture atriale gauche est une complication possible des maladies valvulaires mitrales. La rupture survient à la suite de « jet lesions » qui correspondent à une érosion de l’endocarde à l’endroit spécifique où le reflux mitral se concentre à une vitesse importante.
Un épanchement péricardique chez un chien de petite taille, la présence d’un œdème pulmonaire, une dilatation atriale gauche avec un rapport AG/Ao augmenté, la visualisation d’un caillot dans le péricarde ou encore l’impossibilité de prélever l’épanchement sont autant d’éléments qui peuvent laisser suspecter une rupture atriale gauche.
⊕ Coagulopathie
Des épanchements péricardiques pouvant, dans certains cas, conduire à une tamponnade cardiaque sont rapportés chez presque 1 chien sur 5 cliniques d’une intoxication aux AVK. La mesure des temps de coagulation seront donc indiqués si le contexte s’y prête (jeune chien, accès possible, saignements à d’autres localisations).
Prise en charge : péricardiocentèse, mais pas que !
La péricardiocentèse est le traitement d’urgence de la tamponnade cardiaque !
1
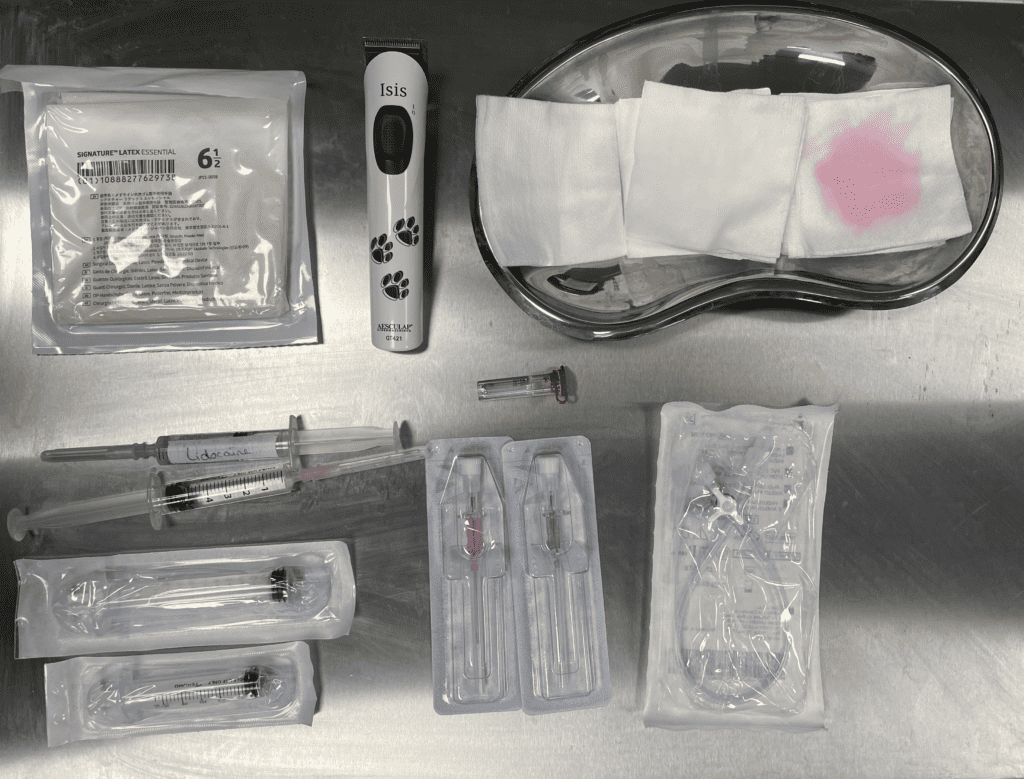
Préparation du matériel
⊕ cathéter rose (20G), vert (18G) ou gris (16G), éventuellement une aiguille Spinocan® (20G)
⊕ prolongateur
⊕ robinet trois voies
⊕ seringues de différentes tailles
⊕ tubes pour analyse
⊕ scrub, tondeuse, gants stériles
⊕ seringue de 1-2 mL de lidocaïne 2%
2
Préparation de l'animal
Une sédation peut être nécessaire, en adaptant le protocole en fonction du statut ASA de l’animal (une association butorphanol et midazolam est souvent suffisante).
La procédure est réalisée à droite, afin d’éviter les gros vaisseaux coronaires. L’animal est donc placé en décubitus sternal ou latéral gauche.
Un monitoring ECG est mis en place. Une dose de lidocaïne (chien : 2 mg/kg) est préparée en cas d’apparition d’arythmies ventriculaires nécessitant un traitement.
L’hémithorax droit est tondu et préparé aseptiquement, du 3ème au 7ème espace intercostal, du sternum à la jonction costo-chondrale.
3
Procédure
Dans l’idéal, au moins deux personnes sont nécessaires.
La ponction sera réalisée de manière échoguidée, au niveau de l’espace intercostal où l’épanchement semble le plus volumineux.
Un petit volume de lidocaïne 2% est injecté sur le lieu de ponction, au sein des tissus musculaire et sous-cutané.
Une incision est réalisée, crânialement à la côte. Le cathéter est inséré perpendiculairement au thorax. Du liquide apparaît lorsque le sac péricardique est ponctionné. Le stylet du cathéter est retiré. Le prolongateur (sur lequel est fixé le robinet trois voies) est branché. L’assistant prélève le liquide à l’aide d’une seringue branchée au niveau du 3 voies. Le liquide est placé dans les tubes nécessaires pour analyse (EDTA, éventuellement tube sec et hépariné). Il est nécessaire de vérifier, au début de la procédure, que l’épanchement ne coagule pas. Si l’épanchement coagule, il est possible qu’une cavité cardiaque ait été ponctionnée.
Le cathéter n'est parfois pas adapté !
Dans certains cas (épanchement péricardique trop épais, cathéter trop court compte-tenu de la taille du chien ou de la présence d’épanchement pleural par exemple), une aiguille à ponction médullaire (Spinocan®) peut être utilisée.
4
Suivi et complications possibles
La péricardiocentèse, geste d’urgence qui ne doit être reportée à plus tard lors de tamponnade, présente quelques complications graves possibles :
⊕ arythmies : extra-systoles ventriculaires, tachycardie ventriculaire, fibrillation
⊕ lacération de l’artère coronaire
⊕ lacération pulmonaire, pouvant entraîner un pneumothorax ou une hémorragie
⊕ dissémination d’agent infectieux, de cellules néoplasiques dans l’espace pleural
Ces animaux doivent donc être hospitalisés sous surveillance rapprochée (examens cliniques fréquents, suivi POCUS), avec un monitoring ECG en continu. En cas d’anomalie (récidive des signes, aggravation clinique, apparition de nouveaux symptômes), une récidive de tamponnade ou une complication de la péricardiocentèse doivent être recherchés.
Pronostic : quoi dire au propriétaire ?
Le pronostic est grandement dépendant de la cause sous-jacente.
⊕ Origine tumorale
Les hémangiosarcomes cardiaques (tumeurs les plus fréquemment associées à une tamponnade) et les mésothéliomes présentent le pronostic le plus sombre. Les hémangiosarcomes sont des tumeurs qui grossissent vite, et la tamponnade peut récidiver rapidement après péricardiocentèse. Pour ces cas-là, une approche palliative est généralement choisie avec les propriétaires (corticothérapie et péricardiocentèse au besoin). Quand la qualité de vie de l’animal est trop impactée, une décision de fin de vie est discutée.
Dans le cas des mésothéliomes, une péricardectomie associée ou non à une chimiothérapie semble présenter des résultats intéressants. Des études ont montré une survie de 6 mois à plus d’un an chez des chiens présentés en tamponnade associée à un mésothéliome, traités par péricardectomie seule. L’association d’une péricardectomie et d’une chimiothérapie permet des survies jusqu’à 27 mois.
Les tumeurs de la base du cœur, quant à elles, ont une croissance lente. Une péricardectomie sub-totale peut donc permettre une survie de plusieurs mois à plusieurs années. L’association d’une corticothérapie et d’une péricardiocentèse à la demande est une option à considérer lorsque la prise en charge chirurgicale ne peut être pratiquée.
⊕ Épanchement péricardique idiopathique
Lors d’épanchement péricardique idiopathique, les récidives sont fréquentes. Une péricardectomie sub-totale peut être proposée après 2 à 3 épisodes, en fonction du délai entre chacun d’entre eux.
⊕ Rupture atriale gauche
Le pronostic lors de rupture atriale gauche est relativement sombre.
Une médiane de survie de 26 jours (0 – 548 jours) a été rapportée dans une étude de 2022. A priori, en cas de survie supérieure à une semaine, le pronostic est alors plutôt bon. Une étude plus ancienne présentait une médiane de survie de 203 jours.
Le chat, cet être à part
Chez le chat, les causes d’épanchement péricardique sont très différentes, et une tamponnade n’est que très rarement associée.
Les cardiomyopathies (CMH notamment) constituent la majorité des cas. Moins fréquemment, une origine néoplasique (lymphome et adénocarcinome) ou infectieuse (PIF, sepsis) est possible, ou encore une hypoalbuminémie, une CIVD ou une origine traumatique.
Une péricardiocentèse en urgence n’est que très rarement indiquée : les épanchements secondaires à une maladie cardiaque sont le plus souvent de faibles quantités, n’entraînant pas de signe clinique.
Découvre tous nos cours !
Inscris-toi à l'une de nos formations ou au Programme Premiers pas en urgence (pack de 3 formations + coaching 1 an)
Références
En savoir plus
♦ Cagle et al. « Diagnostic Yield of Cytologic Analysis of Pericardial Effusion in Dogs ». Journal of Veterinary Internal Medicine 28, no 1 (2014): 66-71.
♦ Davidson et al. « Disease Association and Clinical Assessment of Feline Pericardial Effusion ». Journal of the American Animal Hospital Association 44, no 1 (février 2008): 5-9.
♦ Dunning et al. « Analysis of Prognostic Indicators for Dogs with Pericardial Effusion: 46 Cases (1985-1996) ». Journal of the American Veterinary Medical Association 212, no 8 (15 avril 1998): 1276-80.
Kim, Jung-Hyun, et Jae-Hyun Lim. « Acute fatal pericardial effusion induced by accidental ingestion of cigarette butts in a dog ». The Canadian Veterinary Journal 57, no 2 (février 2016): 151-56.
♦ Lakhdhir et al. « Clinical presentation, cardiovascular findings, etiology, and outcome of myocarditis in dogs: 64 cases with presumptive antemortem diagnosis (26 confirmed postmortem) and 137 cases with postmortem diagnosis only (2004–2017) ». Journal of Veterinary Cardiology 30 (août 2020): 44-56.
♦ Lisciandro, Gregory R., Jennifer M. Gambino, et Stephanie C. Lisciandro. « Thirteen dogs and a cat with ultrasonographically detected gallbladder wall edema associated with cardiac disease ». Journal of Veterinary Internal Medicine 35, no 3 (2021): 1342-46.
♦ Stroope, Sarah, Rebecca Walton, Jonathan Paul Mochel, Lingnan Yuan, et Brittany Enders.
« Retrospective Evaluation of Clinical Bleeding in Dogs With Anticoagulant Rodenticide Toxicity—A Multi-Center Evaluation of 62 Cases (2010–2020) ». Frontiers in Veterinary Science 9 (2022).
♦ Sugiura et al. « Retrospective Evaluation of Clinical Signs, Clinical Course, and Prognosis between Dogs with Left Atrial Rupture Secondary to Myxomatous Mitral Valve Disease and Those with Neoplastic Cardiac Tamponade (2015–2019): 70 Cases ». Journal of Veterinary Emergency and Critical Care 32, no 6 (2022): 784-90